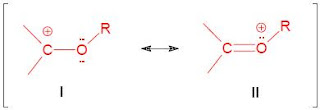
En primer lugar, y lo más importante, está el hecho de que los ácidos carboxílicos son con certeza ácidos. ¿Cómo explicaremos, por ejemplo, que el OH de un ácido carboxílico tiende a liberar un ión hidrógeno con mayor facilidad que el OH de un alcohol? Examinemos las estructuras de reactivos y productos para los dos casos.
Se bserva que el alcohol y el ión alcóxido se representa satisfactoriamente por una sola estructura. En cambio, desarrollamos dos estructuras razonables ( I y II) para el ácido carboxílico, y también dos para el anión carboxilato ambos son híbridos de resonancia. Pero, ¿es igualmente importante la resonancia en los dos casos? Sabemos que la resonancia es mucho más importante entre estructuras equivalentes, como III y IV, que entre estructuras no equivalentes, I y II. Así pues, a pesar de que ácido y anión se estabilizan por resonancia la estabilización es mucho mayor para el anión que para el ácido. El equilibrio se desplaza en la dirección de la ionización mayor, y aumenta Ka.
En primer lugar, y lo más importante, está el hecho de que los ácidos carboxílicos son con certeza ácidos. ¿Cómo explicaremos, por ejemplo, que el OH de un ácido carboxílico tiende a liberar un ión hidrógeno con mayor facilidad que el OH de un alcohol? Examinemos las estructuras de reactivos y productos para los dos casos.
Se observa que el alcohol y el ión alcóxido se representa satisfactoriamente por una sola estructura. En cambio, desarrollamos dos estructuras razonables ( I y II) para el ácido carboxílico, y también dos para el anión carboxilato
ambos son híbridos de resonancia. Pero, ¿es igualmente importante la resonancia en los dos casos? Sabemos que la resonancia es mucho más importante entre estructuras equivalentes, como III y IV, que entre estructuras no equivalentes, I y II. Así pues, a pesar de que ácido y anión se estabilizan por resonancia la estabilización es mucho mayor para el anión que para el ácido. El equilibrio se desplaza en la dirección de la ionización mayor, y aumenta Ka.
En rigor, es más correcto decir que la resonancia es menos importante para el ácido porque las estructuras contribuyentes son de estabilidad diferente, mientras que las equivalentes para el ión deben ser necesariamente de igual estabilidad. En la estructura II, dos átomos de electronegatividad similar portan cargas opuestas; como es necesario aplicar energía para separar cargas opuestas, II debería ser más energética, y por tanto menos estable que I. La consideración de la separación de cargas es una de las reglas empíricas que pueden utilizarse para estimar la estabilidad relativa y, en consecuencia, la importancia relativa de una estructura contribuyente.
Por consiguiente, la acidez de un ácido carboxílico se debe a la fuerte estabilización por resonancia de su anión. Esta estabilización y la acidez resultante sólo son posibles por la presencia del grupo carbonilo.
Propiedades físicas
Los ácidos carboxílicos presentan una polaridad importante, debida al doble enlace carbono-oxígeno y al grupo hidroxilo, que interacciona mediante puentes de hidrógeno con otras moléculas como agua, alcoholes u otros ácidos carboxílicos. Los ácidos carboxílicos de menor tamaño (hasta cuatro carbonos) son totalmente solubles en agua debido a las importantes interacciones que se establecen entre las moléculas del ácido y las de agua. Puros o en disolución acuosa se encuentran formando dímeros unidos mediante puentes de hidrógeno.